第三章 药品研制和生产管理
第一节 药品研制与注册管理
一、药品研制与质量管理规范
新药研制分为三个阶段:第一个阶段是临床前研究阶段,主要包括新活性成分的发现与筛选,并开展药理药效研究和毒理试验(安全性评价试验)。
第二个阶段是新药的临床试验。第三个阶段是生产和上市后研究。每一个研究阶段的研究内容、目的、对象和侧重点各不相同。
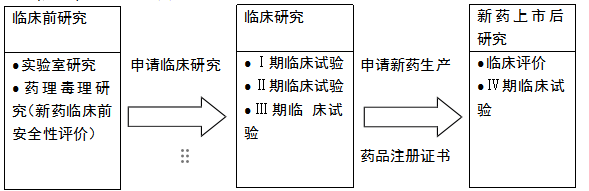
表—药品的研制阶段
| 分期 | 临床实验阶段 | 实验目的 |
| Ⅰ期临床试验 | 初步的临床药理学及人体安全性 评价试验 |
观察人体对于新药的耐受程度和药代动力学,为制定给药方 案提供依据 |
| Ⅱ 期临床试验 | 治疗作用初步评价阶段 |
目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为Ⅲ期临床试验研究设计和给药剂量方案的确定 提供依据。 |
| Ⅲ期临床试验 | 治疗作用确证阶段 |
目的是进一步验证药物对目标适应症患者的治疗作用和安 全性,评价利益与风险关系,最终为药物注册申请的审查提供充分依据。 |
| Ⅳ期临床试验 | 新药上市后的应用研究阶段 |
目的是考察在广泛使用条件下的药物的疗效和不良反应,评价在普通或者特殊人群中使用的利益与风险关系以及改进 给药剂量等。 |
二、药品上市注册
1.药品批准证明文件药品注册证书载明的药品批准文号的格式:
- 境内生产药品:国药准字 H(Z、S)+四位年号+四位顺序号;
- 中国香港、澳门和台湾地区生产药品:国药准字 H(Z、S)C+四位年号+四位顺序号;
- 境外生产药品:国药准字 H(Z、S)J+四位年号+四位顺序号。其中,H 代表化学药,Z 代表中药,S代表生物制品。
第二节 药品上市许可持有人制度
一、药品上市许可持有人基本要求
- 药品上市许可持有人界定
- 药品上市许可持有人资质和能力要求
二、药品上市许可持有人的义务和权利
- 药品上市许可持有人的义务
- 药品全生命周期管理责任
- 建立药品质量保证体系并定期审核
有人应当对受托药品生产企业、药品经营企业的质量管理体系进行定期审核,监督其持续具备质量保证和控制能力。
- 建立药品上市放行规程并严格执行
- 建立并实施药品追溯制度
- 建立年度报告制度
- 中药饮片生产企业履行药品上市许可持有人的相关义务
- 境外药品上市许可持有人的相关义务
- 药品上市后研究
- 药物警戒管理
- 药品上市许可持有人的权利
- 依法自行生产或委托生产药品
血液制品、麻醉药品、精神药品、医疗用毒性药品、药品类易制毒化学品不得委托生产;但是,国务院药品监督管理部门另有规定的除外。
- 依法自行销售或委托销售药品
- 依法委托储存、运输药品
- 依法转让药品上市许可
- 医药代表备案管理
第三节 药品生产管理
一、药品生产许可
- 药品生产许可的申请和审批
- 药品生产许可证管理
- 载明事项
药品生产许可证电子证书与纸质证书具有同等法律效力。
①主动申请注销药品生产许可证的;
②药品生产许可证有效期届满未重新发证的;
③营业执照依法被吊销或者注销的;
④药品生产许可证依法被吊销或者撤销的;
⑤法律、法规规定应当注销行政许可的其他情形。
药品上市许可持有人应当建立药品质量保证体系,履行药品上市放行责任,对其取得药品注册证书的药品质量负责。中药饮片生产企业应当履行药品上市许可持有人的相关义务,确保中药饮片生产过程持续符合法定要求。
药品上市许可持有人应当建立药品上市放行规程,对药品生产企业出厂放行的药品检验结果和放行文件进行审核,经质量授权人签字后方可上市放行。
个月前向所在地省、自治区、直辖市药品监督管理部门报告;
发生非预期停产的,在三日内报告所在地省、自治区、直辖市药品监督管理部门;必要时,向国家药品监督管理局报告。
第四节 药品召回管理一、药品召回与分类
是指药品生产企业对收集的信息进行分析,对可能存在安全隐患的药品进行调查评估,发现药品存在安全隐患的,由该药品生产企业决定召回。
②责令召回
是指药品监管部门经过调查评估,认为存在安全隐患,药品生产企业应当召回药品而未主动召回的,责令药品生产企业召回药品。必要时,药品监督管理部门可以要求药品生产企业、经营企业和使用单位立即停止销售和使用该药品。
- 换发
- 注销
①主动申请注销药品生产许可证的;
②药品生产许可证有效期届满未重新发证的;
③营业执照依法被吊销或者注销的;
④药品生产许可证依法被吊销或者撤销的;
⑤法律、法规规定应当注销行政许可的其他情形。
- 补发
- 药品委托生产管理
二、药品生产质量管理规范与要求
- 药品放行和药品追溯要求
药品上市许可持有人应当建立药品质量保证体系,履行药品上市放行责任,对其取得药品注册证书的药品质量负责。中药饮片生产企业应当履行药品上市许可持有人的相关义务,确保中药饮片生产过程持续符合法定要求。
药品上市许可持有人应当建立药品上市放行规程,对药品生产企业出厂放行的药品检验结果和放行文件进行审核,经质量授权人签字后方可上市放行。
- 短缺药品报告制度
个月前向所在地省、自治区、直辖市药品监督管理部门报告;
发生非预期停产的,在三日内报告所在地省、自治区、直辖市药品监督管理部门;必要时,向国家药品监督管理局报告。
第四节 药品召回管理一、药品召回与分类
- 药品召回和药品安全隐患的界定
- 药品召回分类与分级
- 药品召回分类:
是指药品生产企业对收集的信息进行分析,对可能存在安全隐患的药品进行调查评估,发现药品存在安全隐患的,由该药品生产企业决定召回。
②责令召回
是指药品监管部门经过调查评估,认为存在安全隐患,药品生产企业应当召回药品而未主动召回的,责令药品生产企业召回药品。必要时,药品监督管理部门可以要求药品生产企业、经营企业和使用单位立即停止销售和使用该药品。
- 药品召回分级
对使用该药品可能引起严重健康危害的实施一级召回;
对使用该药品可能引起暂时的或者可逆的健康危害的实施二级召回;
对使用该药品一般不会引起健康危害,但由于其他原因需要收回的实施三级召回。二、药品召回的实施与监督管理
1.药品生产、经营企业和使用单位有关药品召回的义务
(1)药品召回的责任主体
药品上市许可持有人是药品召回的责任主体。
| 通知有关单位 |
生产企业在作出药品召回决定后,应当制定召回计划并组织实施:一级召回在 24 小时内, 二级召回在 48 小时内,三级召回在 72 小时内,通知到有关药品经营企业、使用单位停止销售和使用,同时向所在地省级药品监督管理部门报告。 |
| 报省级药品监督管理部门备案 |
药品生产企业在启动药品召回后,一级召回在 1 日内,二级召回在 3 日内,三级召回在 7日内,应当将调查评估报告和召回计划提交给所在地省级药品监督管理部门备案。省级药品监督管理部门应当将收到一级药品召回的调查评估报告和召回计划报告国家药品监督管理 部门。 |
| 报告召回进展 | 药品生产企业在实施召回的过程中,一级召回每日,二级召回每 3 日,三级召回每 7 日,向 所在地省级药品监督管理部门报告药品召回进展情况。 |
