第七章 特殊管理规定的药品管理
第一节 疫苗管理
一、疫苗分类和管理部门
疫苗的界定
疫苗的分类
免疫规划疫苗,是指政府免费向公民提供,居民应当依照政府的规定受种的疫苗,包括:
②省、自治区、直辖市人民政府在执行国家免疫规划时增加的疫苗;
③县级以上人民政府或者其卫生健康主管部门组织的应急接种或者群体性预防接种所使用的疫苗。
非免疫规划疫苗,是指由居民自费并且自愿受种的其他疫苗。
疫苗的包装标识
目前国家免疫规划的疫苗包括:麻疹疫苗、脊髓灰质炎疫苗、百白破联合疫苗、卡介苗、乙型肝炎疫苗(不包括成人预防用乙型肝炎疫苗),以及各省、自治区、直辖市人民政府增加的免费向公民提供的疫苗。
“免费”字样应当标注在疫苗最小外包装的显著位置,字样颜色为红色,宋体字,大小可与疫苗通用名称相同。
“免疫规划”专用标识应当印刷在疫苗最小外包装的顶面的正中处,标识样式如下图所示(颜色为宝石蓝色)。

第二节 血液制品管理
一、血液制品的界定
血液制品,是特指各种人血浆蛋白制品,包括人血白蛋白、人胎盘血白蛋白、静脉注射用人免疫球蛋白、肌注人免疫球蛋白、组织胺人免疫球蛋白、特异性免疫球蛋白、免疫球蛋白(乙型肝炎、狂犬病、破伤风免疫球蛋白)、人凝血因子Ⅷ、人凝血酶原复合物、人纤维蛋白原、抗人淋巴细胞免疫球蛋白等。
二、血液制品经营管理
开办血液制品经营单位,由省、自治区、直辖市人民政府药品监督管理部门审核批准。
三、进出口血液制品的审批
国务院药品监督管理部门负责全国进出口血液制品的审批及监督管理。
第三节 麻醉药品和精神药品的管理
一、概述
麻醉药品
精神药品
麻醉药品和精神药品的专用标志

管理部门及职责
国务院药品监督管理部门负责全国麻醉药品和精神药品的监督管理工作,并会同国务院农业主管部门对麻醉药品药用原植物实施监督管理。省级药品监督管理部门负责本行政区域内麻醉药品和精神药品的监督管理工作。
国务院公安部门负责对造成麻醉药品药用原植物、麻醉药品和精神药品流入非法渠道的行为进行查处。县级以上地方公安机关负责对本行政区域内造成麻醉药品和精神药品流入非法渠道的行为进行查处。
二、麻醉药品和精神药品目录
| 我国生产及使用的品种及包括的制剂、提取物、提取物粉共有 27 个品种,具体有以下品种。 |
第一类精神药品 |
目前,我国生产及使用的第一类精神药品有 7 个品种,具体有以下品种。 1.哌醋甲酯;2.司可巴比妥;3.丁丙诺啡;4.γ- 羟丁酸;5.氯胺酮;6.马吲哚;7.三唑仑。 |
|
| 麻 醉药 品目录 |
1.可卡因;2.罂粟浓缩物(包括罂粟果提取物、罂粟果提取物粉);3.二氢埃托啡;4.地芬诺酯;5.芬太尼; 6.氢可酮;7.氢吗啡酮;8.美沙酮;
吗啡(包括吗啡阿托品注射液); 阿片(包括复方樟脑酊、阿桔片);11.羟考酮;12.哌替啶;13.瑞芬太尼;14.舒芬太尼;15.蒂巴因; 16.可待因;17.右丙氧芬;18.双氢可待因;19.乙基吗啡;20.福尔可定; 21.布桂嗪;22.罂粟壳。 |
第二类精神药品 |
目前,我国生产及使用的第二类精神药品有 29 个品种,具体有以下品种。 1.异戊巴比妥;2.格鲁米特;3.喷他佐辛;4. 戊巴比妥;5.阿普唑仑;6.巴比妥;7.佐匹克隆;8.氯硝西泮;9.地西泮;10.艾司唑仑;11.氟西泮;12.劳拉西泮;13.甲丙氨酯;14.咪达唑仑;15.硝西泮;16.奥沙西泮;17.匹莫林; 18.苯巴比妥;19.唑吡坦;20.丁丙诺啡透皮贴剂;21.布托啡诺及其注射剂;22.咖啡因;23.安钠咖;24.地佐辛及其注射;25.麦角胺咖啡因;26.氨酚氢可酮片;27.曲马多;28.扎来普隆。 |
| 需要说明的有两点,一是上述品种包括其可能存在的盐和单方制剂(除非另有规定);二是上述品种包括其可能存在的化学异构体及酯、醚(除非另有规定)。 《条例》规定,麻醉药品目录中的罂粟壳只能用于中药饮片和中成药的生产以及医疗配方使用。 |
|||
根据《麻醉药品和精神药品管理条例》有关规定,国家药品监督管理局、公安部、国家卫生健康委员会决定将含羟考酮复方制剂等品种列入精神药品管理:①口服固体制剂每剂量单位含羟考酮碱大于 5 毫克,且不含其他麻醉药品、精神药品或药品类易制毒化学品的复方制剂列入第一类精神药品管理;②口服固体制剂每剂量单位含羟考酮碱不超过 5 毫克,且不含其他麻醉药品、精神药品或药品类易制毒化学品的复方制剂列入第二类精神药品管理;③丁丙诺啡与纳洛酮的复方口服固体制剂列入第二类精神药品管理。
根据《麻醉药品和精神药品管理条例》有关规定,国家药品监管局、公安部、国家卫生健康委决定将瑞玛唑仑(包括其可能存在的盐、单方制剂和异构体)列入第二类精神药品管理。
三、麻醉药品和精神药品生产
生产总量控制
麻醉药品和精神药品的年度生产计划,是由国务院药品监督管理部门根据麻醉药品和精神药品的需求总量制定。
麻醉药品药用原植物年度种植计划,是由国务院药品监督管理部门和国务院农业主管部门根据麻醉药品年度生产计划,共同制定。
定点生产管理
国家对麻醉药品和精神药品实行:定点生产制度。
麻醉药品、精神药品生产,由省级药品监督管理部门审批。
经批准定点生产的麻醉药品、精神药品不得委托加工。
四、麻醉药品和精神药品经营
实行定点经营
国家对麻精药品实行定点经营制度,未经批准的任何单位和个人不得从事麻醉药品和精神药品经营活动。
药品经营企业不得经营麻醉药品原料药和第一类精神药品原料药。但是,供医疗、科学研究、教学使
定点经营企业必备条件
有符合《麻醉药品和精神药品管理条例》规定的麻醉药品和精神药品储存条件。
有通过网络实施企业安全管理和向药品监督管理部门报告经营信息的能力。
单位及其工作人员 2 年内没有违反有关禁毒的法律、行政法规规定的行为。
符合国务院药品监督管理部门公布的定点批发企业布局。
定点经营资格审批
全国性批发企业——跨省、自治区、直辖市从事麻醉药品和第一类精神药品批发业务的药品经营企业。
区域性批发企业——在本省、自治区、直辖市行政区域内从事麻醉药品和第一类精神药品批发企业的药品经营企业
专门从事第二类精神药品批发业务的药品经营企业,应当经所在地省级药品监督管理部门批准。仅取得第二类精神药品批发业务,只能从事第二类精神药品批发业务。
![]() 从事麻醉药品和第一类精神药品批发业务的全国性批发企业、区域性批发企业,可以从事第二类精神药品批发业务。
从事麻醉药品和第一类精神药品批发业务的全国性批发企业、区域性批发企业,可以从事第二类精神药品批发业务。
经所在地设区的市级药品监督管理部门批准,实行统一进货、统一配送、统一管理的药品零售连锁企业可以从事第二类精神药品零售业务。
各级药品零售管理部门应当及时将批准的全国性批发企业、区域性批发企业、专门从事第二类精神药品批发的企业和从事第二类精神药品零售连锁企业(含相应门店)的名单在网上公布。
麻醉药品和第一类精神药品
购进渠道管理
②区域性批发企业,可以从全国性批发企业购进麻醉药品和第一类精神药品,区域性批发企业从定点生产企业购进麻醉药品和第一类精神药品制剂,需经所在地省级药品监督管理部门批准。
销售渠道管理
②全国性批发企业向取得麻醉药品和第一类精神药品使用资格的医疗机构销售麻醉药品和第一类精神药品,须经医疗机构所在地省级药品监督管理部门批准。
③区域性批发企业在确保责任区内医疗机构供药的基础上,可以在本省行政区域内向其他医疗机构销售麻醉药品和第一类精神药品。
④由于特殊地理位置的原因,区域性批发企业需要就近向其他省、自治区、直辖市行政区域内取得麻醉药品和第一类精神药品使用资格的医疗机构销售麻醉药品和第一类精神药品的,应当经企业所在地省级药品监督管理部门批准。
⑤区域性批发企业之间因医疗急需、运输困难等特殊情况需要调剂麻醉药品和第一类精神药品的,应当在调剂后 2 日内将调剂情况分别报所在地省级药品监督管理部门备案。
第二类精神药品
购进渠道管理
销售渠道管理
销售配送要求
全国性批发企业和区域性批发企业向医疗机构销售麻醉药品和第一类精神药品,应当将药品送至医疗机构。医疗机构不得自行提货。
企业销售出库的第二类精神药品不允许购货单位自提,须由供货企业将药品送达医疗机构库房或购买方注册的仓库地址。
药品零售连锁企业对其所属的经营第二类精神药品的门店,应当严格执行统一进货、统一配送和统一管理。药品零售连锁企业门店所零售的第二类精神药品,应当由本企业直接配送,不得委托配送。
麻醉药品和精神药品零售规定
麻醉药品和第一类精神药品不得零售。除经批准的药品零售连锁企业外,其他药品零售企业不得从事第二类精神药品零售活动。
第二类精神药品零售企业应当凭执业医师开具的处方,按规定剂量销售第二类精神药品,并将处方保存 2 年备查。零售第二类精神药品时,处方应经执业药师或其他依法经过资格认定的药学技术人员复核;第二
第二类精神药品零售企业不得向未成年人销售第二类精神药品。在难以确定购药者是否为未成年人的情况下,可查验购药者身份证明。
罂粟壳,必须凭盖有乡镇卫生院以上医疗机构公章的医生处方配方使用,不准生用,严禁单味零售,处方保存 3 年备查。
五、麻醉药品和精神药品使用
使用审批
医疗机构需要使用麻醉药品和第一类精神药品的,应当经所在地设区的市级卫生健康主管部门批准,取得麻醉药品、第一类精神药品购用印鉴卡(以下称印鉴卡)。医疗机构应当凭印鉴卡向本省、自治区、直辖市行政区域内的定点批发企业购买麻醉药品和第一类精神药品。
![]() 设区的市级卫生健康主管部门发给医疗机构印鉴卡时,应当将取得印鉴卡的医疗机构情况抄送所在地设区的市级药品监督管理部门,并报省级卫生健康主管部门备案。
设区的市级卫生健康主管部门发给医疗机构印鉴卡时,应当将取得印鉴卡的医疗机构情况抄送所在地设区的市级药品监督管理部门,并报省级卫生健康主管部门备案。
印鉴卡管理
《印鉴卡》有效期为 3 年。《印鉴卡》有效期满前 3 个月,医疗机构应当向市级卫生健康主管部门重新提出申请。
当《印鉴卡》中医疗机构名称、地址、医疗机构法人代表(负责人)、医疗管理部门负责人、药学部 门负责人、采购人员等项目发生变更时,医疗机构应当在变更发生之日起 3 日内到市级卫生健康主管部门办理变更手续。
市级卫生健康主管部门自收到医疗机构变更申请之日起 5 日内完成《印鉴卡》变更手续,并将变更情 况抄送所在地同级药品监督管理部门、公安机关,报省级卫生健康主管部门备案。
处方资格及处方管理
医疗机构应当按照国务院卫生健康主管部门的规定,对本单位执业医师进行有关麻醉药品和精神药品使用知识的培训、考核,经考核合格的,授予麻醉药品和第一类精神药品处方资格。执业医师取得麻醉药品和
医疗机构应当将具有麻醉药品和第一类精神药品处方资格的执业医师名单及其变更情况,定期报送所在地设区的市级卫生健康主管部门,并抄送同级药品监督管理部门。
执业医师应当使用专用处方开具麻醉药品和精神药品,单张处方的最大用量应当符合国务院卫生健康主管部门的规定。对麻醉药品和第一类精神药品处方,处方的调配人、核对人应当仔细核对,签署姓名,并予以登记;对不符合处方管理规定的,处方的调配人、核对人应当拒绝发药。
医疗机构应当对麻醉药品和精神药品处方进行专册登记,加强管理。麻醉药品处方至少保存 3 年,精神药品处方至少保存 2 年。
麻醉药品和第一类精神药品借用和配制规定
医疗机构抢救病人急需麻醉药品和第一类精神药品而本医疗机构无法提供时,可以从其他医疗机构或者定点批发企业紧急借用;抢救工作结束后,应当及时将借用情况报所在地设区的市药品监督管理部门和卫生健康主管部门备案。
对临床需要而市场无供应的麻醉药品和精神药品,持有医疗机构制剂许可证和印鉴卡的医疗机构需要配制制剂的,应当经所在地省级药品监督管理部门批准。医疗机构配制的麻醉药品和精神药品制剂只能在本医疗机构使用,不得对外销售。
六、麻醉药品和精神药品储存与运输
麻醉药品与第一类精神药品的储存
专库储存
专库和专柜应当实行双人双锁管理。
专人专账管理
专用账册的保存期限应当自药品有效期期满之日起不少于 5 年。
双人验收复核
不合格品处理
药品销毁必须经所在地县级以上药品监督管理部门批准,并在其监督下销毁。药品销毁应有记录并由监销人员签字,存档备查,企业或使用单位不得擅自处理。
第二类精神药品的储存
第二类精神药品经营企业,应当在药品库房中设立独立的专库或者专柜储存第二类精神药品,并建立专用账册,实行专人管理。
对因破损、变质、过期而不能销售的第二类精神药品品种,应清点登记造册,单独妥善保管,并及时向所在地县级以上药品监督管理部门申请销毁。企业不得擅自销毁。
麻醉药品和精神药品运输管理
《麻醉药品、第一类精神药品运输证明》(简称运输证明)。运输第二类精神药品无需办理运输证明。
运输证明有正本和副本,正本 1 份,副本可根据实际需要申领若干份,必要时可增领副本。
运输证明有效期为 1 年(不跨年度)。运输证明应当由专人保管,不得涂改、转让、转借。
托运单位办理麻醉药品和第一类精神药品运输手续时,应当将运输证明副本交付承运单位。
托运麻醉药品和精神药品的单位应确定托运经办人,选择相对固定的承运单位。托运经办人在运单货物名称栏内填写“麻醉药品”“第一类精神药品”或“第二类精神药品”字样,运单上应当加盖托运单位公章或运输专用章。收货人只能为单位,不得为个人。
铁路运输应当采用集装箱或行李车运输麻醉药品和第一类精神药品。采用集装箱运输时,应确保箱体完好,施封有效。
道路运输麻醉药品和第一类精神药品必须采用封闭式车辆,有专人押运,中途不应停车过夜。水路运输麻醉药品和第一类精神药品时应有专人押运。
麻醉药品和精神药品邮寄管理
寄件人应当提交所在地设区的市级药品监督管理部门出具的准予邮寄证明。
寄件人应当在详情单货品名称栏内填写“麻醉药品”或“精神药品”字样,详情单上加盖寄件单位运输专用章。邮寄物品的收件人必须是单位。
第四节 医疗用毒性药品管理
一、概述
医疗用毒性药品的界定
毒性药品的品种与分类
毒性药品中药品种共 27 种
需要说明的是上述中药品种是指原药材和饮片,不含制剂。
毒性药品西药品种共 13 种
需要说明的有两点,一是上述西药品种除亚砷酸注射液、A 型肉毒毒素制剂以外的毒性西药品种是指原料药;二是上述西药品种士的宁、阿托品、毛果芸香碱等包括其盐类化合物。
毒性药品专有标志

二、生产、经营管理
生产、经营资格管理
毒性药品的生产是由药品监督管理部门指定的药品生产企业承担,未取得毒性药品生产许可的企业,不得生产毒性药品。
毒性药品的收购和经营,由药品监督管理部门指定的药品经营企业承担,其他任何单位或者个人均不得从事毒性药品的收购、经营业务。
生产、经营要求
毒性药品年度生产、收购、供应和配制计划,由省级药品监督管理部门根据医疗需要制定并下达。
毒性药品的生产企业须按审批的生产计划进行生产,不得擅自改变生产计划,自行销售。药品生产企业,必须由医药专业人员负责生产、配制和质量检验,并建立严格的管理制度。严防毒性药品与其他药品混杂。
生产毒性药品及其制剂,必须严格执行生产工艺操作规程,投料应在本企业药品检验人员的监督下准确投料,并建立完整的生产记录,保存五年备查。
加工炮制毒性中药,必须按照国家药品标准进行炮制;国家药品标准没有规定的,必须按照省级药品监督管理部门制定的炮制规范进行炮制。药材符合药用要求的,方可供应、配方和用于中成药生产。
储存与运输要求
毒性药品的储存管理要求与麻醉药品的储存管理要求基本相同。收购、经营、加工、使用毒性药品的单位必须建立健全保管、验收、领发、核对等制度,严防收假、发错,严禁与他药品混杂。
储存毒性药品的专库或专柜,其条件要求与储存麻醉药品的专库条件相同,毒性药品可与麻醉药品存放在同一专用库房或专柜。专库或专柜加锁并由专人保管,做到双人双锁管理,专账记录。
毒性药品的包装容器上必须印有毒药标志,在运输毒性药品的过程中,应当采取有效措施,防止发生事故。
药品生产企业应当制定 A 型肉毒毒素制剂年度生产计划,严格按照年度生产计划和药品 GMP 要求进行生产。
注射用 A 型肉毒毒素生产(进口)企业应当指定具有医疗用毒性药品收购经营资质的药品批发企业作为本企业注射用 A 型肉毒毒素的经营企业,并且经指定的经营企业直接将注射用 A 型肉毒毒素销售至已取得
生产经营企业不得向未取得《医疗机构执业许可证》的单位销售注射用 A 型肉毒毒素;药品零售企业不得经营注射用 A 型肉毒毒素。
注射用 A 型肉毒毒素生产(进口)企业和指定经营企业必须严格审核购买单位资质,建立客户档案,健全各项管理制度,加强购、销、存管理,保证来源清楚,流向可核查、可追溯。要建立注射用 A 型肉毒毒素购进、销售台账,并保存至超过药品有效期 2 年备查。
三、使用管理
使用和调配要求
配方用药由有关药品零售企业、医疗机构负责供应。其他任何单位或者个人均不得从事毒性药品的配方业务。
医疗机构供应和调配毒性药品,须凭执业医师签名的正式处方。
每次处方剂量不得超过二日极量。
调配处方时,必须认真负责,计量准确,按医嘱注明要求,并由配方人员及具有药师以上技术职称的复核人员签名盖章后方可发出。对处方未注明“生用”的毒性中药,应当付炮制品。如发现处方有疑问时,须经原处方医生重新审定后再行调配。处方一次有效,取药后处方保存二年备查。
科研、教学使用要求
A 型肉毒毒素的使用规定
第五节 药品类易制毒化学品的管理
一、品种
药品类易制毒化学品品种目录(2010 版)所列物质有:麦角酸;麦角胺;麦角新碱;麻黄素、伪麻黄素、消旋麻黄素、去甲麻黄素、甲基麻黄素、麻黄浸膏、麻黄浸膏粉等麻黄素类物质。(麻黄素也称为麻黄碱)
上述所列物质包括可能存在的盐类
药品类易制毒化学品包括原料药和单方制剂。
二、药品类易制毒化学品的管理
购买许可
《购用证明》只能在有效期内一次使用。
《购用证明》不得转借、转让。
购销管理
药品类易制毒化学品生产企业应当将药品类易制毒化学品单方制剂(如盐酸麻黄碱片、盐酸麻黄碱注射液、盐酸麻黄碱滴鼻液等)和小包装麻黄素销售给麻醉药品全国性批发企业。
麻醉药品全国性批发企业、区域性批发企业应当按照《麻醉药品和精神药品管理条例》第三章规定的渠道销售药品类易制毒化学品单方制剂和小包装麻黄素。
麻醉药品区域性批发企业之间不得购销药品类易制毒化学品单方制剂和小包装麻黄素。
麻醉药品区域性批发企业之间因医疗急需等特殊情况需要调剂药品类易制毒化学品单方制剂的,应当在调剂后 2 日内将调剂情况分别报所在地省级药品监督管理部门备案。
药品类易制毒化学品禁止使用现金或者实物进行交易。
专用账册保存期限应当自药品类易制毒化学品有效期期满之日起不少于 2 年。
第六节 含特殊药品复方制剂的管理
一、部分含特殊药品复方制剂的经营管理
药品购销管理
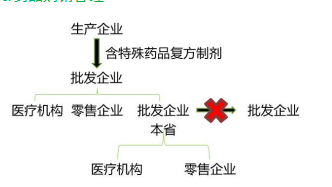
药品零售管理
药品零售企业销售含特殊药品复方制剂时,复方甘草片、复方地芬诺酯片列入必须凭处方销售的处方 药管理,严格凭医师开具的处方销售。
除处方药外,非处方药一次销售不得超过 5 个最小包装(含麻黄碱复方制剂另有规定除外)
含可待因复方口服液体制剂(包括口服溶液剂和糖浆剂)已列入第二类精神药品管理。
复方甘草片、复方地芬诺酯片应设置专柜由专人管理、专册登记。
二、含麻黄碱类复方制剂的经营管理
单位剂量麻黄碱类药物含量大于 30mg(不含 30mg)的含麻黄碱类复方制剂,列入必须凭处方销售的处方管理。
含麻黄碱类复方制剂每个最小包装规格麻黄碱类药物含量口服固体制剂不得超过 720mg,口服液体制剂不
得超过 800mg。
药品零售企业销售含麻黄碱类复方制剂,应当查验购买者的身份证,并对其姓名和身份证号码予以登记。除处方药外,非处方药一次销售不得超过 2 个最小包装。
第七节 兴奋剂的管理
一、概述
我国公布的《2022 年兴奋剂目录》,将兴奋剂品种分为七大类,共计 367 个品种(比 2021 年兴奋剂目录新增 9 个品种),具体品种详见《2022 年兴奋剂目录》。该目录中品种类别分布如下。蛋白同化制剂品种 87 个。
肽类激素品种 68 个。
麻醉药品品种 14 个。
刺激剂(含精神药品)品种 79 个。
药品类易制毒化学品品种 3 个。
医疗用毒性药品品种 1 个。
其他品种(β受体阻滞剂、利尿剂等)115 个。
二、兴奋剂的管理
含兴奋剂药品标签和说明书管理
蛋白同化制剂、肽类激素的经营管理
进口蛋白同化制剂、肽类激素,进口单位应当向所在地省、自治区、直辖市药品监督管理部门提出申请。符合条件的,发给药品《进口准许证》。
出口蛋白同化制剂、肽类激素,出口单位应当向所在地省、自治区、直辖市药品监督管理部门提出申请,符合条件的,发给药品《出口准许证》。
个人因医疗需要携带或者邮寄进出境自用合理数量范围内的蛋白同化制剂、肽类激素的,海关按照卫生计生部门有关处方的管理规定凭医疗机构处方予以验放。
药品《进口准许证》有效期 1 年。
药品《出口准许证》有效期不超过 3 个月(有效期时限不跨年度)。
药品《进口准许证》《出口准许证》实行“一证一关”,只能在有效期内一次性使用,证面内容不得更改。因故延期进出口的,可以持原进出口准许证办理一次延期换证手续。
除胰岛素外,药品零售企业不得经营蛋白同化制剂或者其他肽类激素。
